近日,我所生物分子功能与机制研究组(1821组)朴海龙研究员团队与生物分子高分辨分离分析及代谢组学研究组(1808组)许国旺研究员团队,以及大连医科大学附属第一医院谭广教授团队合作,在前期对蛋白质泛素化及去泛素化相互作用的研究基础上(Oncogene,2020;iScience,2019),进一步发现了去泛素化酶USP22可调控肝癌脂代谢的合成过程,并揭示了USP22可通过氧化物酶体增殖物激活受体γ(PPARγ)促进肝癌脂肪酸合成的新机制,为靶向肝癌脂质合成途径的药物开发提供了新思路。
代谢重编程是癌症的重要特征。脂肪酸从头合成增强是癌细胞中常见的代谢紊乱方式,正常细胞主要是通过外源来摄取和获取脂质的,而癌症细胞则更依赖脂肪酸从头合成维持脂质稳态,以此来满足自身增殖和生长的需求。因此,明确靶向癌症细胞脂肪酸合成过程是治疗肝癌的重要方法之一。
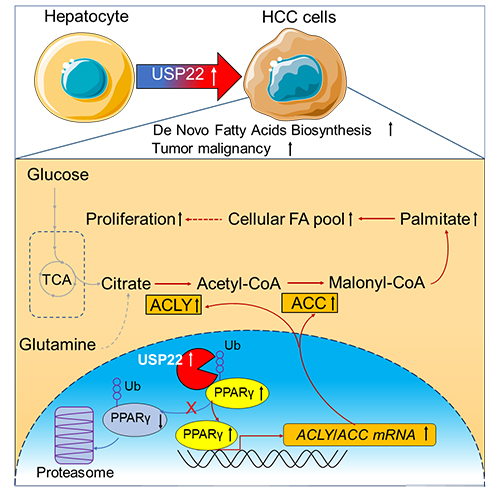
本工作中,研究人员首先通过分析肝癌病理组织中USP家族蛋白的表达情况,并结合代谢组学发现了去泛素化酶USP22与肝癌脂质合成具有显著的相关性;后续通过对细胞分子生物学实验和代谢物的分析,进一步佐证了PPARγ是USP22参与肝癌脂质代谢的重要底物分子。PPARγ是一种配体激活的转录因子,能够激活脂肪酸合成关键酶ACC、ACLY、FASN等的表达,进而促进脂质生成。但是,目前对其调控机制的研究并不完善。研究人员通过生物化学实验证实了USP22可以通过切除PPARγ多个赖氨酸位点的K48泛素链来稳定其表达,稳定表达的PPARγ会进一步激活其靶基因ACC、ACLY的表达,最终促进了脂肪酸从头合成并导致了肝癌的发生。此外,研究团队通过对小鼠模型的研究证实了干扰USP22-PPARγ-ACC/ACLY的信号传导途径除了会抑制脂质合成,还会显著抑制裸鼠瘤的生长。临床组织中USP22与PPARγ、ACC、ACLY的表达都具有显著的正相关性,USP22高表达的肝癌病人预后较差。该工作为靶向肝癌脂肪酸合成的治疗提供了新的科学依据。
相关研究成果以“USP22 Regulates Lipidome Accumulation by Stabilizing PPARγ in Hepatocellular Carcinoma”为题,于近日发表在《自然—通讯》(Nature Communications)上。该工作的共同第一作者是我所1808组博士后宁振、1821组助理研究员刘晓龙和博士毕业生郭新、卢畅。上述工作得到了国家自然科学基金、辽宁省兴辽人才计划、我所创新基金、博士后基金、中科院青促会基金等项目的资助。(文/刘晓龙 图/宁振)
文章链接:https://doi.org/10.1038/s41467-022-29846-9